NORMAS DE SEGURIDAD EN EL LABORATORIO
El trabajo en el Laboratorio requiere la observación de una serie de normas de de seguridad que eviten posibles accidentes debido a desconocimiento de lo que se está haciendo.
1. Dejar siempre las mochilas a la entrada, llevando
solo a la mesa el cuaderno y el bolígrafo.
2. Utilizar ropa cómoda, no utilizar bufandas largas
ni pañuelos .
3. En el caso de tener el cabello largo es
conveniente llevarlo recogido
4. No comer ni beber.
5. Evitar los desplazamientos injustificados,
mantener siempre el mismo lugar de trabajo.
6. No tocar nada del material preparado para la
práctica hasta que lo indique la profesora
7. No arrojar objetos sólidos a las pilas, para ello
están los recipientes de basura.
8. Con el material de vidrio utilizar siempre pinzas
a la hora de calentarlo.
9. No tirar objetos calientes (vidrio, cerillas,
etc.) a los recipientes de basura donde generalmente hay papeles y otros
materiales inflamables.
10. Cuidar siempre que las llaves de los mecheros de
gas están cerradas.
11. No cambiar las pipetas, ni cuentagotas del
frasco que las contiene.
12. En caso de accidente o rotura de material
,avisar inmediatamente a la profesora
13. No tocar ni oler ni probar ningún producto químico.
14. Lava tus manos antes de salir del laboratorio.
15. Al finalizar comprueba que todo el material ha
quedado limpio y en orden, los
aparatos desconectados. Cierra las llaves del agua y
apaga los mecheros.
PICTOGRAMAS DE SEGURIDAD EN EL LABORATORIO
Un pictograma es
un signo dibujado y no lingüístico, que representa figurativamente (de
forma más o menos realista) un objeto real, o un significativo.
“Un pictograma debería
ser enteramente comprensible
con solo tres miradas.”
“En el diseño de un
pictograma deberían suprimirse
todos los detalles superfluos.”
En la actualidad, es
entendido como un signo claro y esquemático que sintetiza un mensaje o información sobrepasando
la barrera del lenguaje, y con el objetivo de informar y/o señalizar
Los pictogramas que
pueden aparecer en la etiqueta de una sustancia química y su significado.
· Peligro de corrosión: Estos productos son corrosivos y son, por ejemplo: los que atacan y destruyen los metales y los que queman la piel y/o los ojos en caso de contacto o proyección.
· Gases a presión: Son gases a presión dentro de un recipiente que pueden: explotar bajo efectos del calor: Gases comprimidos, licuados o disueltos. Los gases licuados refrigerados pueden provocar quemaduras y heridas por frío.
· Peligro para la salud: Estos productos químicos pueden ser: Tóxicos a grandes dosis. Irritantes para los ojos, nariz, la garganta o la piel. Pueden causar alergias en la piel (eczema). Pueden causar somnolencia o vértigos.
· Peligro de explosión: El producto puede explotar en contacto con una llama, una chispa, electricidad estática, por calor, por un choque, fricción … Son por ejemplo: Materiales explosivos, materiales autoreactivos y ciertos peróxidos orgánicos.
· Peligro de incendio: El producto puede inflamarse: en contacto con una llama, una chispa, electricidad estática. Por efecto del calor, fricción. En contacto con el aire. En contacto con el agua, emiten gases inflamables.
· Productos comburentes: El producto puede provocar o agravar un incendio o provocar una explosión en presencia de productos inflamables.
· Peligro para la salud: Estos productos se clasifican en una o más de estas categorías: cancerígenos, mutágenos y tóxicos para la reproducción. Alteran el funcionamiento de ciertos órganos como el hígado, sistema nervioso … Estos efectos tóxicos pueden aparecer con una o varias exposiciones. Causan daños a los pulmones y pueden ser mortales su entran en el tracto respiratorio. Causan alergias respiratorias (asma, por ejemplo). Estos productos pueden ejercer su toxicidad por vía oral, cutánea o por inhalación.
· Peligro para el medio ambiente: Son productos que pueden causar efectos nocivos sobre los organismos del medio acuático.
Laboratorio virtual: simulador de microscopio online
EL MICROSCOPIO ÓPTICO
Está conformado por tres sistemas:
El sistema mecánico está constituido por una serie de piezas en las que van instaladas las lentes que permiten el movimiento para el enfoque.
El sistema óptico comprende un conjunto de lentes dispuestas de tal manera que produce el aumento de las imágenes que se observan a través de ellas
El sistema de iluminación comprende las partes del microscopio que reflejan, transmiten y regulan la cantidad de luz necesaria para efectuar su observación.
El sistema mecánico:
BRAZO.- Donde se debe sujetar, las pinzas, el carro, el tubo del microscopio y el revólver. Sirve para trasladar el microscopio de un lugar a otro.
PIE.- Proporciona estabilidad y sirve de soporte a todas las partes del microscopio.
PLATINA.- Pieza metálica, cuadrada, en su centro una abertura circular por la que pasará la luz del sistema de iluminación. Se coloca el portaobjetos a observar.
PINZAS DE SUJECION.- Parte mecánica, para sujetar la preparación. Las pinzas poseen un carro con dos tornillos, que permiten un avance longitudinal y transversal de la preparación.
TORNILLO MACROMETRICO: Movimiento rápido hacia arriba o hacia abajo de la platina para localizar la imagen a observar.
TORNILLO MICROMETRICO o de enfoque suave.
TUBO.- Parte mecánica que proporciona sostén a los oculares y objetivos.
El sistema óptico:
OCULAR.- Capta y amplia la imagen formada en los objetivos. Los microscopios actuales poseen dos oculares, uno para cada.
OBJETIVOS: Pequeños cilindros colocados en el revólver que proporciona el poder de resolución del microscopio y determinan la cantidad total de aumento.
Existen 4 tipos:
1.- La lupa (4 X) que sirve para hacer observaciones a bajo aumento.
2.- El objetivo (10 X) que se utiliza para localizar la imagen que se va a observar.
3.- El objetivo (40 X) aumenta la imagen anterior, para poder observar se necesita enfocar el objetivo hasta que aparezca la imagen.
4.- El objetivo de inmersión (100 X) es un lente especial para observar imágenes tan pequeñas como las bacterias. Y se requiere del aceite de inmersión.
La parte óptica del microscopio es la que determina el número de aumentos que presenta la imagen observada .El aumento total que permite un microscopio óptico se calcula multiplicando el objetivo por la que producen los oculares.
Un objetivo de 40x (aumenta 40 veces) y un ocular de 10x (aumenta 10 veces), el resultado final será de 400x, la muestra aumentada 400 veces.
El sistema iluminación:
La fuente luminosa consiste en un espejo o una fuente de luz eléctrica que dirige un haz de luz hacia el condensador.
CONDENSADOR.- Es una lente de gran abertura que permite dirigir la mayor parte de los rayos luminosos en la preparación.
DIAFRAGMA: Existe un diafragma en el condensador, que elimina el exceso de luminosidad para tener una buena iluminación del objeto a observar
FUENTE DE LUZ.- La muestra microscópica necesita que esté iluminada con luz y cuentan con un foco que da energía eléctrica que dirige sus rayos luminosos hacia el sistema condensador.
EL MICROSCOPIO ELECTRÓNICO.
Utiliza una fuente de electrones para observar la muestra y se clasifican en dos:
1.-De Transmisión lineal porque los electrones atraviesan la muestra y la reflejan en una pantalla fluorescente, aumentando la imagen a unas 200,000 veces más que el ojo humano.
2.-De Barrido Superficial porque los electrones no atraviesan la muestra, solamente recorren la superficie como si la barrieran, proyectándola en una pantalla de televisión, aumentando la imagen hasta 1,000,000 de veces.
Microscopio de fluorescencia
- Se utiliza para observar sustancia fluorescentes denominadas fluoróforos. Una molécula fluorescente es aquella que es capaz de captar radiación electromagnética con una longitud de onda determinada y emitir otra radiación electromagnética con otra longitud de onda diferente, normalmente dentro del espectro de la luz visible.
Microscopio de contraste de fases
- Realiza modificaciones en la trayectoria de los rayos de luz, los cuales producen contrastes notables en la preparación.
- ¿Qué diferencias se aprecian entre las células
animales y vegetales observadas?¿Cuáles pueden ser generalizables?
- ¿El azul de metileno es un colorante ácido o
básico?¿Por qué?
IDENTIFICACIÓN DE GLÚCIDOS REDUCTORES
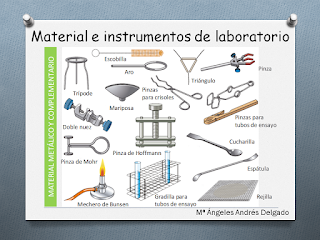
Material
utilizado
Procedimiento
Hidrólisis
de la sacarosa
IDENTIFICACIÓN DE ALMIDÓN
Objetivo
Materiales
utilizados
Procedimiento
Pruebas
con alimentos
IDENTIFICACIÓN
DE LÍPIDOS
Objetivo
Materiales
utilizados
Procedimiento
Objetivo
Materiales
utilizados

EXTRACCIÓN
DEL ADN DE LAS CÉLULAS
Confirmar, a partir de la longitud enorme de las fibras, que en el núcleo el ADN se encuentra replegado.
Para la extracción de ADN de hígado de pollo, lavavajillas, sal común (NaCl), agua destilada, líquido limpia lentes, alcohol de 96º, probeta, batidora y microscopio óptico.
Procedimiento
OBSERVACIÓN DE BACTERIAS DEL YOGUR. TINCIÓN DE GRAM
Objetivo
Materiales utilizados
Procedimiento












































































No hay comentarios:
Publicar un comentario